Сравнительный анализ безопасности и эффективности игл для аспирационной биопсии печени. Экспериментальное исследование.
Вестник новых медицинских технологий, 2009. Том 16. №4 с 178-182
В.Г. Ившин, С.А. Ларин, Ю.Г. Андреев
ООО «Центр новых медицинских технологий» г.Тула
ООО «Минимально инвазивные технологии» г.Железнодорожный Московской обл.
Эффективность применения различных игл мы оценивали по количеству и качеству получаемых биоптатов печени.
Изучены иглы с заточкой «как карандаш» под углом 22º; с трехгранной заточкой под углами 14, 18, 22 и 25º; с односторонней заточкой под углом 30º; с односторонней заточкой и подточкой краев среза; с двугранной заточкой под углом 25º. Исследуемые иглы имели диаметры 0,8; 1,1; 1,25; 1,6 мм.
Выявили, что иглы малого диаметра и иглы с острыми углами заточки легче прокалывают капсулу печени, но и более легко ее и разрывают. Наиболее выражены эти свойства у игл с заточкой «как карандаш». Иглы большего диаметра обладают наименее выраженной колющей способностью, но и более безопасны в плане разрыва капсулы печени. Более безопасны в плане разрыва капсулы печени иглы с трех- и двухгранной заточкой.
На величину силы разрыва паренхимы печени наиболее влияет диаметр иглы. Легче всего вызывают разрыв паренхимы печени тонкие (0,8 мм) иглы.
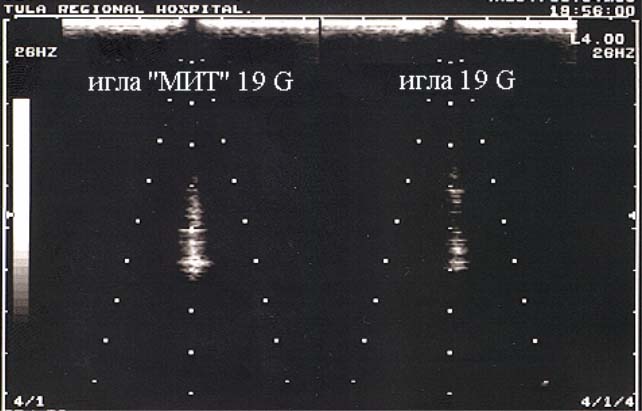
Минимальную ультразвуковую визуализацию имеют иглы малого диаметра; а циркулярные метки, нанесенные с помощью высокоэнергетического лазера, поперечный срез дистального конца, подточка среза дистального конца и нарезка на стилете в максимальной степени усиливают ультразвуковую визуализацию игл.
Увеличение калибра иглы существенно влияет на объем получаемого биоптата. При выполнении аспирационной биопсии печени предпочтительно применение игл с трехгранной заточкой. По сравнению с другими иглами их применение позволяет получать биопсийного материала в 1,5 – 3,5 раза больше.
Менее всего травмируют биопсийный материал иглы с углами заточки 14º и 18º. Увеличение глубины разрежения в игле (до 83,3 кПа) снижает качество получаемого биопсийного материала.
Введение. В последнее время отмечен рост числа больных с опухолевыми образованиями печени [2, 3, 4, 6-9]. Это связано как с увеличением заболеваемости, так и с улучшением диагностики при применении таких современных методов, как ультразвуковое исследование, компьютерная томография, ядерно-магнитный резонанс, цветное допплеровское картирование, ангиография и др. Одновременно происходит совершенствование техники операций на печени и проведения анестезии, что позволяет существенно расширить показания к оперативному лечению больных с опухолевыми заболеваниями печени [1, 5, 10, 11, 12]. У больных с нерезектабельными образованиями печени может быть применен целый ряд малоинвазивных методов лечения: чрескожная некротизирующая терапия (инъекции этанола, крио-, термо- и радиочастотная аблация), химиоинфузия и химиоэмболизация ветвей печеночной артерии, химио- и механическая эмболизация ветвей воротной вены и др.
Решение вопросов показаний и противопоказаний к оперативному лечению, объему резекции печени, целесообразности использования малоинвазивных методов лечения, прогнозирования отдаленных результатов лечения в основном зависит от гистологической природы и распространенности опухолевого процесса. В связи с этим значительно возрастает роль пункционной биопсии с целью предоперационной верификации объемных образований печени.
В настоящее время для биопсии печени применяют три группы игл: аспирационные, модифицированные аспирационные и режущие. Аспирационные иглы имеют тонкостенные канюли с кончиками, заточенными под разными углами. Модифицированные аспирационные иглы имеют канюлю с заточенными острыми краями и кончики различной формы и предназначены для взятия как цитологических, так и гистологических образцов. При применении модифицированных аспирационных игл, фрагменты тканей, пригодные для гистологического изучения удается получить в 38 - 92% биопсий Режущие иглы бывают двух типов: Menhini, имеющая в канюле щелевидный разрез с острыми краями, и Tru-Cut, имеющая канюлю с острыми краями и внутренний стилет с вырезкой. По частоте получения образца тканей для гистологического исследования режущие иглы превосходят модифицированные аспирационные.
По диаметру биопсийные иглы делят на иглы малого калибра – 25 - 21 Gauge (0,51 – 0,82 мм), среднего калибра – 20 - 18 Gauge (0,95 – 1,25 мм) и крупного калибра 16 -14 Gauge (2,0 – 1,65 мм). Применение более толстых режущих игл увеличивает риск процедуры, который особенно возрастает при нарушении свертывания крови. А сложная конфигурация режущих игл делает их существенно дороже модифицированных аспирационных.
Учитывая вышеизложенное, и принимая во внимание современные тенденции развития отечественной гепатологии - увеличение числа центров, выполняющих резекции печени и чрескожные малоинвазивные методы; перенос большинства диагностических вмешательств на амбулаторно-поликлинический этап, представляется актуальным выполнение работы, направленной на сравнительный анализ и повышение безопасности и эффективности различных игл, применяемых для аспирационной биопсии печени.
Материал и методы исследования. Для оценки безопасности применяемых игл мы провели серию экспериментальных исследований, направленных на изучение способности вызывать прокол и разрыв капсулы и паренхимы печени, а также ультразвуковой визуализации дистальных концов игл.
Колющую способность, силу разрыва капсулы и паренхимы печени исследовали у следующих игл (рис. 1): с заточкой «как карандаш» (№ 1) под углом 22º; с трехгранной заточкой (№ 2) под углами 14, 18, 22 и 25º; стандартной иглы с односторонней заточкой (№ 3) под углом 30º; односторонней иглы с подточкой краев среза (№ 4); с двугранной заточкой под углом 25º (№ 5). Исследуемые иглы имели диаметры 0,8; 1,1; 1,25; 1,6 мм.

|
|
Рис 1. Биопсийные иглы, исследованные в экспериментах. 1- с заточкой «как карандаш»; 2 - с трехгранной заточкой; 3 - стандартная игла с односторонней заточкой; 4 - стандартной иглы с подточкой краев среза; 5 - с двугранной заточкой. |
Для изучения колющей способности игл мы сконструировали специальное приспособление (рис. 2). Приспособление состоит из основной столешницы (1), которая с помощью струбцины (2) крепится к любой горизонтальной поверхности; П-образной арки (3), жестко прикрепленной к основной столешнице. В центре П-образной арки имеется отверстие, в которую вставлена втулка (4) для введения и фиксации игл. К П-образной арке с помощью кронштейна (5) крепится граммометр (6) часового типа.
Для измерения силы, необходимой для разрыва капсулы и паренхимы печени устройство дополнили подвижной столешницей (7) (рис. 3) с остроконечными фиксаторами (8). Для стабилизации иглы в вертикальном положении на П-образной арке разместили 2 ограничителя (9). Граммометр переместили с П-образной арки на основную столешницу.
Измерение колющей способности игл выполняли следующим образом (рис. 4). На основной столешнице располагали цельную неповрежденную печень свиньи. В отверстие втулки на П-образной арке вставляли иглу до соприкосновения ее кончика с капсулой печени. В этом положении иглы с помощью упора (7) устанавливали «0» на шкале граммометра. Осуществляли плавное надавливание на павильон иглы и отмечали показания граммометра в момент прокола капсулы печени. Показания граммометра переводили в систему СИ.
Изучение силы, вызывающей разрыв капсулы печени выполняли следующим образом (рис. 5). На подвижную столешницу размещали неповрежденную печень свиньи весом 1 кг. Остроконечные фиксаторы обеспечивали неподвижность печени относительно подвижной столешницы. В отверстие втулки П-образной арки вводили иглу до соприкосновения ее кончика с капсулой печени. В этом положении иглы с помощью упора (7) устанавливали «0» на шкале граммометра. Используя результаты предшествующего опыта, на павильон иглы осуществляли давление, на 10 гр. меньшее давления прокола капсулы печени для игл данного диаметра и заточки. При этом отмечали прогибание печени под кончиком иглы. С помощью упора (7) иглу фиксировали в этом положении. Граммометр переносили на основную столешницу и вводили в соприкосновение с упором на подвижной столешнице. С помощью крюка создавали тягу подвижной столешницы в горизонтальной плоскости и отмечали показания граммометра в момент разрыва капсулы печени.
Изучение силы, необходимой для разрыва ткани печени, проводили аналогичным образом, но при этом иглы вводили в ткань печени на глубину 1, 2, 3, 4, 5 и 6 см (рис. 6). Форму заточки иглы при этом не учитывали, поскольку длина заточенного кончика иглы несопоставимо меньше длины участка иглы, погруженного в печень.

|
|
Рис. 2. Приспособление для измерения силы прокола. |

|
|
Рис. 3. Приспособление для измерения силы разрыва капсулы и паренхимы капсулы печени |
|
|
|
|
Рис. 4. Схема измерения колющей способности игл. |
Рис. 5. Схема измерения силы разрыва капсулы печени. |
Рис. 6. Схема измерения силы разрыва паренхимы печени. |
Учитывая, что одним из наиболее важных условий успешного и безопасного выполнения чрескожных вмешательств является хорошая ультразвуковая визуализация иглы, мы также изучили яркость свечения дистальных концов игл в опытах на фантомах. Исследовали 24 различных иглы, 23 из которых имели калибр 19 G, и 1 - игла Chiba – 22 G. Стандартная игла имела ровную поверхность и одногранный срез дистального конца под углом 30º. Дистальные концы 20 игл были дополнительно обработаны. Для этого применяли травление поверхности агрессивными жидкостями, нанесение различных шероховатостей, меток, рисок и лунок с помощью абразива, бора или лазера, изменение формы заточки.
Исследования проведены с помощью ультразвукового аппарата SSD - 250 A фирмы Toshiba. Иглы вводили под контролем пункционного датчика 4 Мгц на глубину 6 см под углом 75º и 90º к поверхности фантома (дегазированная вода). Измерения осуществляли при одинаковых показателях мощности излучения, глубины сканирования, яркости, контрастности и пр. Путем вращения игл добивались максимально яркого свечения дистального конца и проводили гистографическое исследование его эхографического изображения на участке экрана дисплея, ограниченном кругом радиусом 1 см, с абсолютно черным фоном (без отраженных эхосигналов). По гистограмме оценивали: процент площади выделенного участка, дающий свечение (100 - MAX); неоднородность яркости свечения выделенного участка (SD) и среднюю яркость свечения выделенного участка (M). Увеличение яркости свечения и, соответственно, визуализации иглы математически характеризовалось возрастанием площади свечения; увеличением неоднородности свечения и увеличением средней яркости свечения выделенного участка.
Каждый опыт для всех игл повторяли десятикратно. Рассчитывали среднюю арифметическую и среднюю ошибку средней арифметической.
Эффективность применения различных игл мы оценивали по количеству и качеству получаемых биоптатов печени. Для оценки количества биопсийного материала производили взвешивание на аналитических весах ВЛР-200. Первоначально взвешивали биопсийную иглу без мандрена. Затем вставляли мандрен и вводили иглу в паренхиму свиной печени. Удаляли мандрен, к игле подсоединяли удлинительный адаптер и шприц объемом 25 мл. С помощью шприца вызывали разрежение - 73,5 кПа. При постоянном разрежении иглу однократно продвигали на 20 мм в глубь ткани печени. Шприц отсоединяли, отверстие павильона иглы закрывали пальцем и быстрым движением удаляли иглу из печени. Взвешивали иглу с биоптатом и вычитали вес иглы до пункции. Забор материала выполняли иглами диаметром 0,8; 1,1; 1,25; 1,65 мм со всеми 5 типами заточки дистального конца. Для каждой иглы опыт повторяли десятикратно. Все процедуры выполняли также со шприцом 35 мл, создававшим разрежение - 83,3 кПа. Рассчитывали среднюю арифметическую и среднюю ошибку средней арифметической.
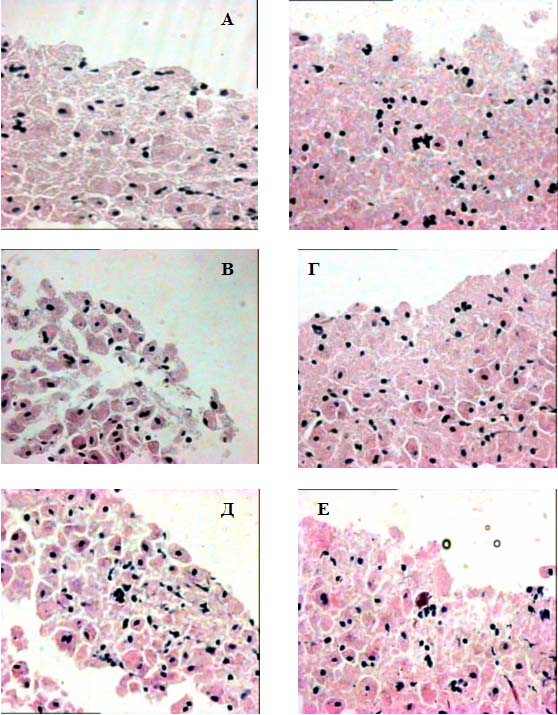
Качество получаемого биопсийного материала мы оценивали при выполнении биопсии печени свиньи иглами с трехгранной формой заточки дистального конца диаметром 1,25 мм и углами заточки 14, 18 и 25º. Биопсию печени свиньи выполняли при разрежении – 73,5 кПа (шприц объемом 25 мл) и 83,3 кПа (шприц объемом 35 мл). Каждой иглой биопсию выполняли пятикратно. Фиксацию биоптатов, приготовление и окраску микропрепаратов осуществляли в одинаковых условиях. Окраску микропрепаратов осуществляли гемотоксилин-эозином, микроскопию – с помощью бинокулярного микроскопа Nicon Eclipse E-400. При исследовании тканевого столбика отмечали длину, диаметр и неровность его контуров. При гистологическом исследовании качество биоптата оценивали по следующим критериям: неровность контура тканевого столбика, межклеточные разрывы тканевого столбика, деформация клеток по краям тканевого столбика, деформация ядер клеток краев тканевого столбика. Выраженность каждого признака оценивали как слабую (+), умеренную (++) или сильную (+++).
Результаты и обсуждение. При исследовании колющей способности игл выявили, что при различных вариантах и углах заточки, а так же диаметрах игл сила необходимая для прокола капсулы печени варьирует от 1,055 до 2,065 Н.
Сила прокола капсулы печени зависит от формы заточки иглы (табл. 1). Наилучшая колющая способность отмечена у иглы с заточкой «как карандаш» (№ 1). Наиболее плохую колющую способность имеют иглы с трехгранной (№ 2) и двугранной заточкой (№ 5). Игла с одногранной заточкой занимает промежуточное положение. Нанесение подточки на края среза стандартной иглы не улучшает ее колющих свойств. Данные закономерности отмечены при исследовании игл с различными диаметрами.
Независимо от формы заточки дистального конца увеличение диаметра иглы ведет к ухудшению ее колющей способности. Наиболее легко прокалывают капсулу печени иглы диаметром 0,8 мм.
Изменение угла заточки иглы в меньшей степени влияет на силу прокола капсулы печени (табл. 2). Изменение значения силы прокола капсулы печени при различных углах заточки имеет недостоверный характер при всех типах заточки игл. Однако отмечается тенденция к возрастанию этой величины с увеличением угла заточки иглы.
|
Таблица 1.
Сила (Н), необходимая для прокола капсулы печени в зависимости от диаметра и формы заточки дистального конца иглы.
|
|||||||||||||||||||||||||||||||||||
|
|||||||||||||||||||||||||||||||||||
|
Примечание:
|
* - р<0,05 по сравнению с иглой такой же заточки диаметром 0,8 мм.
** - р<0,05 по сравнению с иглой № 3 такого же диаметра. |
||||||||||||||||||||||||||||||||||